कार्बन और उसके यौगिक
अमोनिया का अणु:
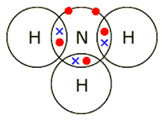
अमोनिया (NH3) का अणु नाइट्रोजन के एक परमाणु और हाइड्रोजन के तीन परमाणुओं से बना होता है। नाइट्रोजन की बाहरी कक्षा में 5 इलेक्ट्रॉन होते हैं, जबकि हाइड्रोजन की बाहरी कक्षा में 1 इलेक्ट्रॉन होता है। हाइड्रोजन के तीन अलग अलग परमाणुओं के साथ नाइट्रोजन एक-एक इलेक्ट्रॉन साझा करता है। इस तरह से नाइट्रोजन की बाहरी कक्षा में अष्टक पूरा हो जाता है। दूसरी ओर, हाइड्रोजन के हर परमाणु को एक-एक इलेक्ट्रॉन मिलता है ताकि हर परमाणु की बाहरी कक्षा में 2 इलेक्ट्रॉन हो जाते हैं। इस तरह से नाइट्रोजन और हाइड्रोजन; दोनों अपने नजदीकी नोबल गैस वाली कंफिगरेशन प्राप्त कर लेते हैं।
मीथेन का अणु:
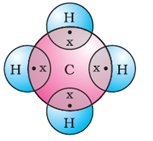
मीथेन (CH4) का एक अणु कार्बन के एक परमाणु और हाइड्रोजन के चार परमाणुओं से बना होता है। कार्बन की बाहरी कक्षा में 4 इलेक्ट्रॉन होते हैं, जबकि हाइड्रोजन की बाहरी कक्षा में 1 इलेक्ट्रॉन होता है। हाइड्रोजन के हर परमाणु के साथ कार्बन एक-एक इलेक्ट्रॉन साझा करता है। इस तरह से कार्बन की बाहरी कक्षा में अष्टक पूरा हो जाता है। दूसरी ओर, हाइड्रोजन के हर परमाणु को एक-एक इलेक्ट्रॉन मिलता है ताकि हर परमाणु की बाहरी कक्षा में 2 इलेक्ट्रॉन हो जाते हैं। इस तरह से कार्बन और हाइड्रोजन; दोनों अपने नजदीकी नोबल गैस वाली कंफिगरेशन प्राप्त कर लेते हैं।
कार्बन के अपरूप:
जब कोई तत्व एक ही भौतिक अवस्था में विभिन्न रूपों में पाया जाता है तो इसे अपरूपता कहते हैं। किसी तत्व के अपरूपों के रासायनिक गुण समान होते हैं लेकिन भौतिक गुण अलग-अलग होते हैं। कार्बन के तीन अपरूप हैं; ग्रेफाइट, हीरा और फुलेरीन।
ग्रेफाइट: ग्रेफाइट में कार्बन का प्रत्येक परमाणु कार्बन के तीन अन्य परमाणुओं से जुड़ा रहता है। इनमें से एक डबल बॉन्ड होता है और बाकी दो में सिंगल बॉन्ड होते हैं। हर कार्बन परमाणु के तीन अन्य कार्बन परमाणुओं से जुड़ने के कारण ग्रेफाइट में षटकोणीय व्यूह बनता है। ग्रेफाइट में षटकोणीय परतें एक दूसरे के ऊपर लगी होती हैं। ग्रेफाइट छूने पर मुलायम और चिकना लगता है। यह विद्युत का सुचालक होता है।
हीरा: हीरे में कार्बन का प्रत्येक परमाणु कार्बन के चार अन्य परमाणुओं से जुड़ा होता है। इस तरह से हीरे में हर बॉन्ड एक सिंगल बॉन्ड होता है। इससे हीरे में थ्री डाइमेंशनल रचना बनती है। हीरा अब तक की जानकारी के अनुसार सबसे कठोर प्राकृतिक पदार्थ है। यह विद्युत का कुचालक होता है।
फुलेरीन: फुलेरीन में कार्बन परमाणुओं की सजावट हीरे जैसी ही होती है। फुलेरीन किसी जिओडेसिक ग्लोब की तरह दिखता है।
कार्बन की बहुमुखी प्रकृति
कार्बन असंख्य नम्बर के कंपाउंड बनाता है। एक अनुमान के मुताबिक कार्बन के 30 लाख कंपाउंड के फॉर्मूले पता हैं। यह सब कार्बन के निम्नलिखित गुणों के कारण संभव हो पाता है:
कैटेनेशन: कार्बन का एक परमाणु कार्बन के चार अन्य परमाणुओं के साथ बॉन्ड बना सकता है। कार्बन की इस क्षमता को कैटेनेशन कहते हैं। इसके कारण, कार्बन के कंपाउंड में कार्बन परमाणुओं की लंबी चेन, शाखा वाली चेन और यहाँ तक की रिंग भी हो सकते हैं। इन कंपाउंड में कार्बन के परमाणुओं के बीच सिंगल, डबल या ट्रिपल बॉन्ड हो सकता है।
कोई भी दूसरा तत्व कैटेनेशन के मामले में कार्बन जैसी क्षमता नहीं दिखाता है। सिलिकॉन भी हाइड्रोजन के साथ मिलकर कंपाउंड बनाता है जिसमे सिलिकॉन परमाणुओं की संख्या 8 तक हो सकती है। लेकिन इस तरह के कंपाउंड अत्यधिक प्रतिक्रियाशील होने के कारण स्टेबल नहीं होते हैं। लेकिन कार्बन और कार्बन के बीच का बॉन्ड काफी प्रबल होता है। इसलिये कार्बन के कंपाउंड काफी स्टेबल होते हैं।
टेट्रावैलेंसी: कार्बन के पास चार वैलेंस इलेक्ट्रॉन होते हैं, यानि यह टेट्रावैलेंसी दिखाता है। इसलिये यह कई अन्य तत्वों के साथ बॉन्ड बना सकता है; जैसे ऑक्सीजन, हाइड्रोजन, सल्फर, क्लोरीन, आदि। इसलिये कार्बन के कंपाउंड बनने की असीम संभावनाएँ होती हैं। कार्बन के परमाणु के छोटे आकार की वजह से ऑर्गेनिक कंपाउंड के बॉन्ड काफी प्रबल होते हैं। इससे कार्बनिक कंपाउंड को अच्छी स्टैबिलिटी मिल जाती है।